新井好史(日本医療研究開発機構/ スクリーニング学研究会)
POINT
スクリーニングを成功させるためにまず重要なことは、目的とする化合物の特性(プロファイル)を明確にすることである。そのうえで、その化合物を選択するために必要な各種アッセイ系(試験系や評価系など)を作成すると同時に、それらアッセイ系を実施する手順、スクリーニングカスケードを設定することである。なお、「スクリーニング」と「ハイスループットスクリーニング(HTS)」の違いを厳密に示すことは困難なため、その点は上手く解釈していただきたい。
アッセイ系とスクリーニング系
まず「アッセイ(assay)」と「スクリーニング(screening)」という言葉について整理したい。
- アッセイとは、辞書的には、分析(評価)する、検定するという言葉が当てられる。
- スクリーニングとは、篩(ふるい)にかけることである。
この2つの言葉はしばしば混同されて使われることがあるが、一般に、アッセイ系とは一つの評価系を指す。例えば、酵素の阻害活性を測定する評価系や受容体への結合阻害を測定する評価系等がある。対して、スクリーニング系とは、多数の対象物の中から目的とする特性をもつものを選別することであり、スクリーニングにかけられる化合物をアッセイする濃度や選抜基準の設定等も含まれた概念である。スクリーニング系が一つのアッセイ系で成立している場合もあるが、複数のアッセイ系を組合わせて一つのスクリーニング系が成立していることも多い。
本稿は、スクリーニングカスケード、すなわち複数のアッセイ系をどのように組合わせてスクリーニングを実行するのがよいのかを考えることが目的である。なお、同じ意味でスクリーニングフローという言葉が使われることもあるが、本書では「スクリーニングカスケード」を使う。このスクリーニングカスケードは「目的とする化合物を選抜・取得するための戦略的アプローチである」ともいえる。
医薬開発におけるヒット、リード
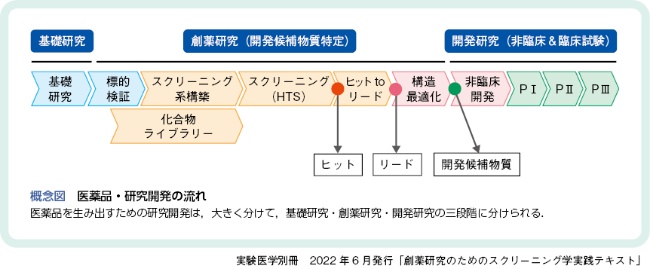
1. 医薬品の研究開発の流れ
医薬品の研究開発の流れは、概念図のように示される。ここに示された一連の過程は、医薬品を開発するためのスクリーニングカスケードであるともいえる。しかし、本書は、「スクリーニング(HTS)とその周辺」に焦点を当てており、本書で述べる「スクリーニングカスケード」とは、この図の「スクリーニング(HTS)」のなかのヒット確定まで、またはその後の「ヒットtoリード」までが対象である。
こうした医薬開発の過程において、「ヒット」と「リード」という言葉は特に重要な意味をもつが、各研究組織や会社などで異なる定義で用いられていることが多い。そのため、本書では以下のように定義した。
2. ヒット・リードの定義
1)ヒット
ヒット化合物とは、あるスクリーニング系で設定した活性基準を満たすことが見出された化合物(活性化合物)であり、単一のアッセイ系に対して活性が確認された化合物のことや、複数のアッセイ系を組合わせて選択した化合物のこともある。
このヒットの概念には広がりがあり、例えば、1次ヒット*1、アクティブ*2とヒットの使い分け、HTSヒット*3、Confirmed hit*4やQualified hit*5など、各研究組織ごとに種々の意味で使われることがあることに留意する。
*1 1次ヒット:1次スクリーニングで選択された化合物。
*2 アクティブ:HTSで得られたヒットを、より高次のアッセイ系にて細胞での活性や特異性などが確認されたヒットと区別してアクティブとよぶことがある。
*3 HTSヒット:HTSで得られたヒット。
*4 HTSヒット:Confirmed hit:一つのスクリーニング系で確定したヒットや、それに加えてより高次のアッセイ系も含めて確認されたヒットを指すこともある。
*5 Qualified hit:より高次のアッセイ系にて細胞での活性や特異性などが確認されるなど、より目的にかなったヒット。
2)リード
リード化合物とは、主に医薬品候補化合物を創出する過程で、最適化のための合成展開をする際の出発点となる化合物である。スクリーニングより得られたヒットから「ヒットtoリード」の過程を経て見出される。目的とする生理活性・薬理活性をもつだけではなく、化学構造や物性、生体内での動態や各種相互作用、安全性を考慮し、さらには知財戦略なども含めて総合的に判断された化合物のことである。
ただし、本書では特に生理活性・薬理活性面に重点を置いて、下記の内容を考慮した化合物を「リード化合物」と記述する。
- 標的*6に対する親和性や有効性などの特性が、特定の測定方法に依存しないで認められること
- 標的との確かな相互作用があること(標的なしの場合には生理活性や薬理活性に影響がでないこと)
- 標的に対して、許容範囲内の選択性が確認できること
- その他、以下の点も考慮されること
- 複数の類似関連化合物に活性があり、合成による構造展開性があると認められること
- 膜透過性、代謝安定性、タンパク質結合率、CYPへの結合や誘導に関して許容されること
- 細胞毒性との乖離がしっかりあること
*6 ここでいう標的は、必ずしも具体的に同定されていない場合も含む
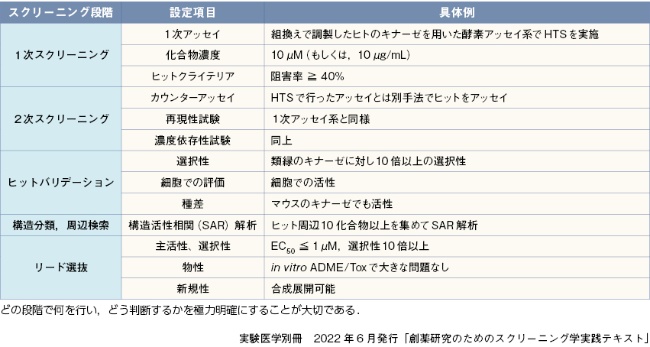
本書では、ヒット、およびリードの定義を上記のように定めるが、リード化合物に必要とされる基準(リードクライテリア)の具体例を表1に示す。これはあくまでも参考例であり、項目や値はそれぞれの考え方に応じて設定することとなる。
スクリーニングカスケードの設計
1. HTSにおける基本手順
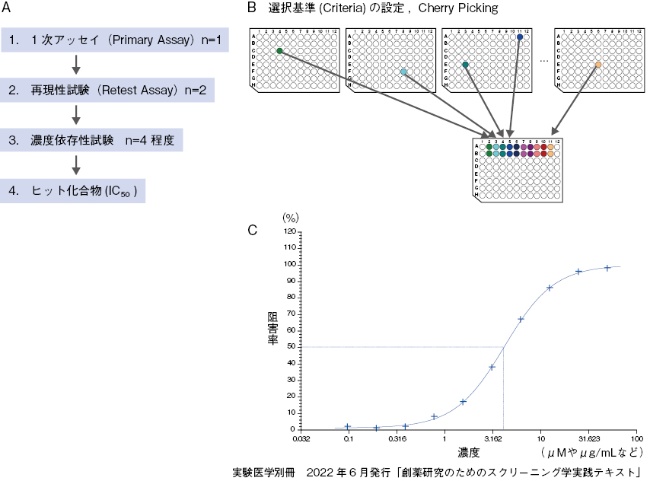
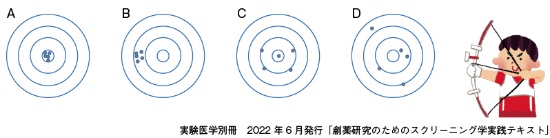
HTSにおけるスクリーニングの基本手順は以下の通りである1)。例として、酵素Aの阻害化合物を得る目的で、酵素Aの阻害活性を測定するアッセイ系を使ってスクリーニングを実施する場合の最も基本的な手順を示す(図1A)。
- 1次アッセイ(Primary Assay)、通常n=1:化合物ライブラリーの個々の化合物試料に対して(濃度は、例えば10μg/mLの1条件で統一)、設定したアッセイ系を用いて阻害率を算出し、一定の阻害率以上の化合物を選択する。
- 再現性試験(Retest Assay)、通常n=2:一定の選択基準(クライテリア)を設定して選ばれた化合物に対して、再度アッセイを行い、阻害率を算出して、決められた阻害率以上の活性を示した化合物を選択する。HTSでは、ここでの再現率は必ずしも高い値を示さない(理由はコラム9を参照)。
なお、この再現性試験を実施するために、1次アッセイでのヒットだけを集める作業が必要であり、この操作をチェリーピッキング(cherry picking)という(図1B)。
- 濃度依存性試験、通常n= 4程度:化合物試料の希釈系列を作成して、それぞれの濃度における阻害率を求める。縦軸:阻害率、横軸(対数):濃度のグラフにプロットしてIC50値を算出する(図1C)。
- ヒット化合物:一定のIC50値以上の活性化合物をヒットと認定する。
2. スクリーニングカスケードの設計において考慮すべき内容
前項にて、HTSを実施するうえでもっとも基本的な手順を示した。この基本スキームに加えて、目的の特性をもつ化合物を取得するために必要なアッセイ系を組み入れたスクリーニングカスケードを設定する。
実際にスクリーニングカスケードを設計する際には、スクリーニングの目的(めざす特性をもつ化合物の取得)や使うアッセイ手法に応じて、以下に例示するさまざまな視点を考慮して各種アッセイ系を組合わせる必要がある。
設定したカスケードが適切であるかどうかは、一定数のパイロットスクリーニング(条件設定・ 確認のための小規模なスクリーニング)を実施して、1次アッセイ系の質(Z′ファクターなどで確認)や選択基準の設定と妥当性、実際のヒット率などを確認する。これを経て、よりよいカスケードに変更することもある。スクリーニング対象とする化合物数が大規模の場合は、初期段階での適切なカスケード設計は特に重要である。
考慮すべき内容例:
- カスケードで設定したアッセイ系は並行して同時に行うこともある。
- カウンターアッセイ系を加えて、偽陽性化合物(場合により擬陽性化合物)でないこと、および検出系に依存しない活性であることを確認する。
- ターゲットサブタイプの選択性や影響を検証する。
- 動物細胞に対する毒性評価を加える。
- ターゲットアッセイ後に、細胞を使ったフェノタイプアッセイで確認する。
- アフィニティーアッセイ後に、機能阻害活性を確認する。
- 擬似的なアッセイ手法を使った後に、真の標的への効果を確認する。
擬似的なアッセイ手法の例:
- 目的とするタンパク質の代わりに発光タンパク質を発現する系。
- 病原体を使わずに、病原性を回避したアッセイ系を採用する。
化合物関連の考慮すべきことの例:
- 化合物ライブラリーの試料の純度が高いとは限らないため、提示されている化合物が活性化合物であるかどうかの検証が必要である。ときに不純物として含まれていた化合物が活性を示すこともあるため、必要な分析や化合物の再調製などを行う(コラム10参照)。
- 天然物エキスを試料として使う際には、混合物であるがゆえの考慮をする。例えば、ヒット試料の分画操作行うことや複数濃度でのアッセイを行うなど。
- 化学構造を確認して、毒性を示唆する構造や物性を考慮するなど、その後の創薬に懸念のない化合物を選択する。
スクリーニングカスケードの例
ここでは、実例を紹介する。東京大学創薬機構2)が行っているスクリーニングに関するセミナーで使われている資料を一部改変して紹介する。
図2の例では、スクリーニングによりヒットを決定した後に、リードの選抜、最適化研究までを例示している。
1. キナーゼの例
キナーゼ阻害剤のスクリーニングカスケード例を表2に示す(東京大学創薬機構セミナー)。HTSの基本スキームに、カウンターアッセイ、選択性試験、細胞を使った評価、種差間の評価を組み込んだ例である。詳細は11章-1を参照いただきたい。
2. その他の参考例
多くのスクリーニング関係の文献にさまざまなカスケードが紹介されている。例えば、アストラゼネカ社が行ったRSウイルス (respiratory syncytial virus)の複製阻害剤のHTSスクリーニングカスケード3)では、1次スクリーニングでRSウイルスのレプリコンを使った細胞感染モデル(RSV replicon luminescence-reporter assay)を使っている。その後の再現性アッセイや濃度依存性試験では、同時に細胞毒性評価を行いながらレプリコンアッセイでのヒット(阻害化合物)を得ている。これは、化合物の細胞への影響が、発光を指標にしたアッセイ結果に大きく影響を与えるために、同時並行して各アッセイでの評価を行ったものと推察される。
レプリコンでの発光アッセイでのヒット化合物は、その後、生のRSウイルスを使ったアッセイ系とそのホスト細胞への影響を見ることで、このスクリーニングにおけるヒット化合物を確定させている。ここでは、約100万化合物を対象にして、カスケード内の各スクリーニングでの通算ヒット率も提示されており、最終的に379のヒット化合物(ヒット率0.4%)が得られている。
また、ネクロトーシス(necroptosis)阻害剤のスクリーニングでは、3段階のスクリーニングカスケードの中にin vitro、in silico、およびin vivoの方法を含む10のアッセイ系を組み合わせたHTSの例がある4)。
その他、第10回スクリーニング学研究会(2019年)のWS11(work shop 11)では、スクリーニングカスケード(スクリーニングフロー)について、参加者(主に製薬企業やアカデミアの研究者)がグループにわかれて議論を行い、その結果として、具体的なカスケードを作成している。その際の議論や内容がまとめられているが、大いに参考になるだろう5)。
おわりに
スクリーニングカスケードの設計はスクリーニング戦略そのものである。目的とするヒット化合物を効率よく得るためには、適切なスクリーニングカスケードの設定が不可欠である。どのようなアッセイ系や検出系でスクリーニングを行うか、目的外の化合物をどのように排除するのか、どの程度の規模のライブラリーに対してスクリーニングを行うのか、また、その化合物ライブラリーの特徴は何なのか等々によって、どのようなカスケードが適当であるかは異なってくるため、正解が一つとはいえない。
しかし、スクリーニングを行うポリシーは明確にしておくべきである。
文献・Webサイト
1)新井好史:化学と生物、38:264-269, 2000
2)東京大学創薬機構。https://ift.tt/P5GHfED (2022年2月参照)
3)Plant H, et al:J Biomol Screening, 20:597-605, 2015
4)Brito H, et al:Cell Death Discov, 6:6, 2020
5)第10回スクリーニング学研究会:WS11.【スクリーニングフロー構築 ~目指すヒットを選抜するために~】まとめ。https://screenology.org/index.php/ws-reports/117-ws-reports-10th/632-10th-ws11-report(2022年2月参照)
COLUMN 1 データ解析時の信頼性にかかわる用語
笹又美穂(スクリーニング学研究会)
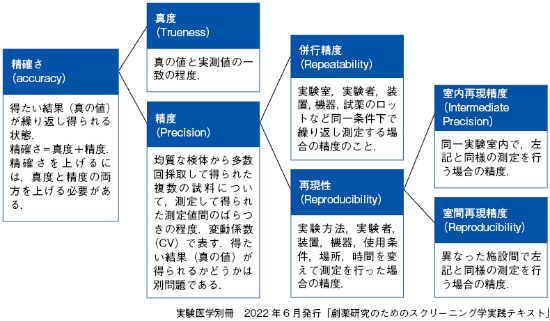
本コラムでは、本書で登場するデータ解析時に用いられる用語を紹介する。本コラムの用語は、スクリーニングの分野での実験室の現場で慣用的に使用されている用語の説明であり、分析の分野で使用されている用語とは少し異なる場合があることをご承知おきいただきたい。 ■信頼性にかかわる用語
■その他の用語
・特異性(Specificity):試料中に共存すると考えられる物質の存在下で、測定対象物を正確に測定する能力
・変動係数(Coefficient of Variation:CV):平均に対する、データのばらつきの大きさの比率」を表す指標。変動係数(CV)=標準偏差/平均値。
・検出限界(Detection Limit):試料中に存在する測定対象物の検出可能な最低の量のこと。
・定量限界(Quantitation Limit):適切な精度と真度を伴って定量できる、試料中に存在する測定対象物の最低の量のこと
・直線性(Linearity):試料中の測定対象物の濃度(量)と直線関係にある測定値を与える能力のこと。
・範囲(Range):分析法が適切な精度、真度および直線性を与える試料中の測定対象物の上限および下限の濃度(量)の間隔。
・頑健性(Robustness):アッセイの条件を小さい範囲で故意に変動させたときに、測定値が影響を受けにくい能力のこと。通常の作業状態におけるアッセイの信頼性の指標となる。
スクリーニング学研究会/編
目次
序
序章 総論―ようこそ「スクリーニング学」へ!【新井好史】
第1章 スクリーニングカスケード
1 スクリーニングカスケードの設定と戦略【新井好史】
第2章 創薬アプローチ(ターゲット別) 1 Target-Based ScreeningとPhenotypic Screening【岡部隆義】
2 酵素阻害(活性化)【武本 浩】
3 受容体結合阻害(活性化)【村越路子】
4 タンパク質 - タンパク質相互作用(PPI)を標的とした創薬【小田上剛直】
5 イオンチャネルをターゲットとしたスクリーニングの考え方【守口由紀子,我謝徳一】
第3章 アッセイ手法(検出・測定法別)
1 吸光度・濁度測定【佐藤朝実】
2 発光法【桃井道子】
3 蛍光法【高城多恵子,笹又美穂】
4 蛍光偏光【和田玲子】
5 ELISA法【出井晶子】
6 TR-FRET(HTRFとLANCE)【村越路子,武本 浩】
7 Alpha技術によるHTS【竹田浩之】
8 質量分析(MS)~High-Throughout Mass Spectrometry(HTMS)【寺西文恵】
9 ラジオアイソトープ(RI:放射性同位元素)【佐藤秀樹,村越路子】
10 細胞イメージング【大野 研】
11 物理化学的手法 ~特異的相互作用を評価するための定量解析【長門石 曉,津本浩平】
12 レポーターアッセイとそのHTSへの応用【片岡健輔】
13 GPCRでよく使われるアッセイ【村越路子】
14 イオンチャネルをターゲットとした化合物スクリーニングの概要【日比野良祐,関 梓】
15 細胞毒性アッセイ【米倉慎一郎】
16 タンパク質断片相補アッセイ【出井晶子】
第4章 スクリーニング方法と結果の検証
1 アッセイ系評価【岡部隆義】
2 スクリーニング実施評価【和田玲子】
3 フォールスポジティブ・フォールスネガティブ【岡部隆義】
第5章 化合物ライブラリー
1 化合物ソースの種類(低分子,中分子),DEL【神山 務】
2 化合物管理 ~スクリーニングアッセイは化合物の分注からはじまる【髙宮万里】
3 化合物自動倉庫 ~導入に至る経緯と役割【濱田幸宣】
第6章 プレートアッセイ関連技術
1 マイクロプレートアッセイ【村越路子】
2 分注機の種類と特徴【樽井 寛】
3 プレートリーダー【菅 郷志】
4 アッセイに必要な周辺装置【笹又美穂,村越路子,内田 実】
第7章 自動化(オートメーション)
1 概論―実験の自動化の歴史を知り新たな革新へ【笹又美穂】
2 自動化に貢献する機器の進化 ~分注機を中心に【三井郁雄】
3 実験の自動化に関する基礎知識 ~周辺機器の特徴と選び方【笹又美穂,内田 実】
4 実験自動化システムの分類と導入時の考察ポイント【須山英悟】
5 自動化システムの構築にあたり知っておくべきこと【浅野秀光】
6 自動化システム実践編 “ソフトウェアと自動化” ~ソフトウェア選択とエラー対策の重要性【内田 実】
第8章 ヒットtoリード
1 ヒットバリデーション【谷口友美】
2 リード認定・過程【神山 務】
第9章 特徴のあるスクリーニング
1 コンピュータを利用したバーチャルスクリーニング【大田雅照】
2 プーリングアッセイ【新井好史】
3 フラグメントベースドスクリーニング【幸 瞳】
4 天然物スクリーニング【村松康範,奥田彰文】
5 感染症スクリーニング【新井好史】
6 DNA encoded library(DEL)スクリーニング【須田三記也】
第10章 データ登録と網羅的解析
1 HTS データ処理 ~データの登録,可視化,網羅的解析【妹尾千明,和田玲子】
第11章 スクリーニング実施例
1 カップリング反応によるキナーゼ阻害剤のスクリーニング【今村理世】
2 Echo MSを利用したスクリーニング【長谷川 司】
3 HTRF法を用いた細胞系HTS【武本 浩】
4 ロミデプシンの発見に学ぶ系設計のノウハウ【上田博嗣】
索引
執筆者一覧
COLUMN
1 データ解析時の信頼性にかかわる用語【笹又美穂】
2 in vivo(個体)アッセイ【辻 直城】
3 IC50と阻害定数(inhibitor constant:Ki)の関係(酵素編)【新井好史】
4 結合実験(binding assay)の基本【新井好史】
5 競合実験(competition assay)におけるKiとIC50(結合阻害編)【新井好史】
6 界面活性剤(Detergent)をうまく使おう【笹又美穂】
7 クロストーク【工藤 勤】
8 クエンチング:カラークエンチングとケミカルクエンチング【工藤 勤】
9 ベイズの定理:ヒットしたのに再現性がない?【岡部隆義】
10 ライブラリー化合物の純度について【新井好史】
11 DMSOの怖い吸湿【髙宮万里】
12 撹拌が重要【村越路子,笹又美穂】
13 静電気によって発生する問題と対応について【内田 実】
14 リガンド効率(ligand efficiency:LE)【新井好史】
15 HTS実施時の試薬類,消耗品などの調達,調製【今村理世】
からの記事と詳細 ( スクリーニングカスケードの設定と戦略:日経バイオテクONLINE - 日経バイオテク )
https://ift.tt/9m5x3Zo



No comments:
Post a Comment