生命現象の理解には、分子レベルでコントロールされる個々の相互作用を正確に決定することが必須といえる。生命分子の相互作用は、解析法により異なる結果となることがあるため、複数の原理の異なる解析によるクロスバリデーションは欠かすことができない。また、相互作用の中身を特異性と親和性の観点で捉えること、そして、物理化学的な側面、すなわち速度論的・熱力学的パラメーターを決定することも重要となる。さらに、最近発展が著しいシミュレーション技術を組み合わせることで、相互作用の動的な分子機構の理解や予測へとつながっている。これらの相互作用解析の特徴について解説する。
津本浩平(東京大学大学院工学系研究科 教授)
前仲勝実(北海道大学薬学研究院 教授)
生命現象と相互作用:速度論と熱力学の重要性
生命現象を分子とその相互作用で記述する学問が分子生物学である。生命現象の多くにおいて重要となるタンパク質と生理的リガンドとの相互作用を正確に把握することが真の姿の理解につながる。このことは、生命分子の相互作用を多角的に記述することの重要性、すなわち相互作用の原子レベルでの記述とその熱力学的理解、速度論的理解の重要性を示している。さらに、生理的リガンドに拮抗する分子を見出すこと、あるいはその相互作用を制御するリガンドの創出が創薬やライフサイエンス研究へと貢献する。これがケミカルバイオロジーとよばれる学問分野の本質である。
1.「特異性」と「親和性」
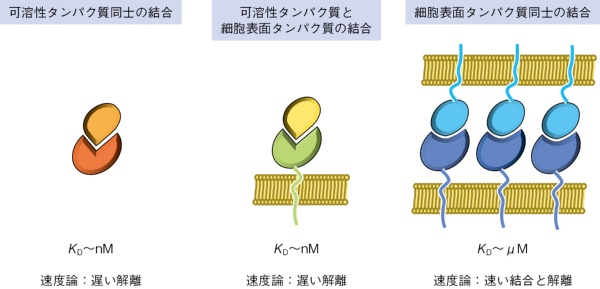
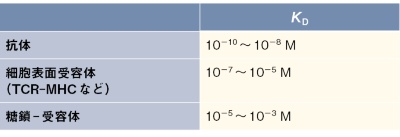
生命分子の相互作用は特異性の高いものから低いもの、また、親和性の高いものから低いものまで存在する。分子の生理的な役割により、それぞれに適した相互作用の種類が用いられており、その相互作用の特徴を知るためには「特異性」と「親和性」を考えておくことが重要である(図1)。例えば、抗体がその抗原を認識する場合、解離定数KD~nMオーダーが典型的である非常に高い親和性を示し、同時に、抗原に対する高い特異性を有することが一般的である。他方、細胞表面受容体は標的細胞表面にある抗原との相互作用において、解離定数KD~μMオーダーの中程度の弱い親和性を示すが、生理的リガンドに対して十分な特異性を示す。これは、適切なシグナルを伝達するために、生理的なリガンドの数や密度を識別するために、このような弱い相互作用を用いていると考えられる。また、非常に親和性の低い糖鎖を認識する細胞表面受容体は、特異性を維持して、多数の糖鎖を有する細胞や微生物をアビディティー(avidity、多価)効果で識別する。このように特異性・親和性を利用してリガンド認識に対して、異なるストラテジーを取るのである(表1)。
アビディティー
「1:1」の一価同士の結合の強さが親和性(アフィニティー)であるが、「1:複数」や「複数:複数」のような多価分子の結合により、例えば、結合細胞膜に固定されたタンパク質と複数の結合部位をもつ多価リガンドの間など、相互作用の複数の親和性が加算されることにより、見かけの親和性が向上する効果を指す。
以上のように相互作用の特異性は、生命現象のいわゆる生物学と密接に連関しているものである。このことは、物理化学的解析により一義的に生命現象を語ることができるわけではなく、おのおのの生物学に適した物理化学が存在し、その記述が重要であること、また、その物理化学に基づいた創薬が重要であることを意味している。
2.「速度論」的な側面
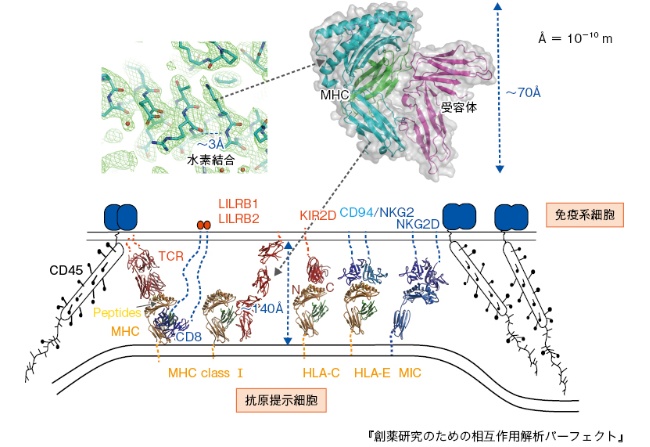
さらに、相互作用には速度論的な側面が存在する。すなわち、相互作用する場合の会合と解離のステップである。速く会合する必要があるかないかを理解することはたいへん重要である。抗体のような可溶性分子ではリガンドを見出すスピードが重要になるので、会合速度は特に重要となる。他方、細胞膜にアンカーされるような細胞表面受容体や抗原同士の結合では、細胞自体が標的細胞に近づき、膜間の相互作用が必要であるので、タンパク質レベルだけではなく、細胞のレベルでの理解が重要である(図2)。
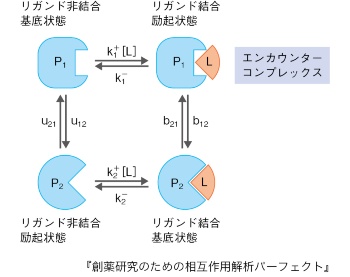
速度論的な側面でもう1つ大事な理解に、相互作用分子が出会う段階に形成される遭遇複合体(エンカウンターコンプレックス)がある(図3)。よく知られた概念に、相互作用のプロセスにおける誘導適合(induced fitting)と、構造選択(conformational selection)があり、今なおそのプロセスに関する議論が進んでいる。今後、計算科学的解析の進歩と相まって、より深い議論が可能になるであろう(図3)。
誘導適合
相互作用においてタンパク質が示す標的分子特異性において、標的分子との結合がタンパク質の結合部位の構造を、特異性を示すように変化させるようにする、という考え方をいう。最近では、酵素の作用機序におけるいわゆる鍵と鍵穴の関係の拡張版で、タンパク質や標的分子を動的存在であるとすることで説明できるといわれることもある。
構造選択
標的分子と結合可能なようなタンパク質のコンフォメーション(立体配座)は標的分子の存在とは独立に存在していて、標的分子がタンパク質の適切なコンフォメーションを選択して結合する、とする説のこと。タンパク質の高次構造は不均一であり、異なるコンフォメーションの平衡がある事実が一般化してきたが、標的分子が、そのコンフォメーションの中から最適な構造を選択する、とされている。
3.「熱力学」的な側面
一方、相互作用には熱力学的な側面が存在する。すなわち、相互作用が平衡となっている状態における、相互作用前とのエネルギー差に関する理解が重要である。例えば、相互作用によって形成される水素結合、ファンデルワールス力等の非共有結合が強い場合は、発熱量が大きくなり離れにくい。これがエンタルピー支配型(あるいはエンタルピー駆動型)とよばれるものである。それに対して、相互作用前に多数存在する水和水を除く効果、いわゆる脱水和の効果が大きい相互作用においては、水素結合の切断による吸熱量が大きくなり、相互作用によって形成される非共有結合による発熱量を上回る。これがエントロピー支配型(エントロピー駆動型)とよばれるものである。
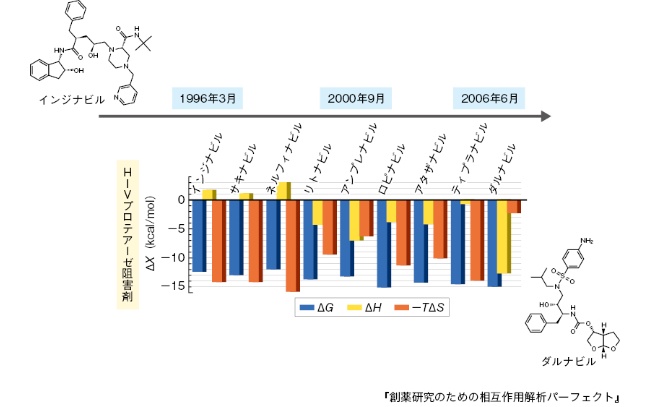
例をあげよう。相互作用がエントロピー支配型であった薬剤を、水素結合を導入したり、形状相補性を改良したりして、エンタルピー支配型に変えた例がある。HIVプロテアーゼ阻害剤では結果として優れた薬剤の開発に成功した(図4)。また、ほとんどの治療抗体は、免疫系によってエンタルピー支配型の分子種である。
以上をまとめると、相互作用の種類は多様であること、その機能を発揮する「場」での親和性、特異性、速度論的および熱力学的パラメーターが相互に関連していることを前提に、生命現象における相互作用について、詳細を記述する必要がある、ということになる。さらにそれぞれの特徴をもつ相互作用が、狭い範囲で複数生じうることがある。細胞膜間の受容体と抗原の相互作用の例を図2に示した。
相互作用解析の実際:クロスバリデーションの重要性
これまで相互作用の内容や例について取り上げたが、この相互作用は必ず原理の異なる複数の分析手法で確定(クロスバリデーション)する必要がある。報告されている相互作用にもいまだ再現性の得られないものも少なくない。相互作用はバッファー等の測定条件を精度よく準備し、どの条件で親和性・特異性の高い相互作用を発揮するかをよく検討しておくべきである。これらの条件が影響して、作用点での活性の違いも十分に起きうるので、留意するべきである。他方、フェノタイプアッセイでは複数の因子がかかわるため相互作用する真の標的がわからない、あるいは間違えるケースがある。1990年代半ばの例をあげると、ヒト免疫系分子HLA-Gが免疫系受容体CD94/NKG2のリガンドであると細胞実験から示唆された報告が複数出たが、実際にはHLA-G分子の分解されたペプチドがヒト免疫系分子HLA-Eに提示され、これをCD94/NKG2が認識することがわかった。このようにリガンドと同定されたもののなかには、発現誘導による他の分子が標的となる間違いも起きる。対策として、純度の高い組換えタンパク質を用いた系で、相互作用があることを確定する必要がある。現在の標準的な学術誌で、リガンドや受容体の同定にタンパク質レベルでのデータを必ず求められるのはこのような背景があるからである。
他方、創薬の観点から見ると、フェノタイプアッセイで得られるヒット化合物では複数のターゲットが標的になることがあり、薬効の高い化合物へと最適化が進むうちに、当初想定していた標的では説明がつかなくなるケースもあるほか、最終的に異なるタンパク質に特異的・高親和性の結合を示すことになる場合もある。その場合も組換えタンパク質を用いた相互作用解析が必須となる。ここではさらに立体構造解析が決定的な役割を果たす。実際に低分子化合物が結合している構造が得られれば、結合を強く示唆するものとなり、化合物の誘導体の結合構造と活性相関(構造活性相関)が得られれば、相互作用を確定できる。
相互作用解析と創薬:構造情報に基づいた理解と計算科学の重要性
最後に創薬の観点から相互作用を取り上げる。低分子・中分子創薬が、標的分子のある特定の部位において作用点、結合を創出することが重要である、いわゆる点結合の設計である。相互作用プロセスの理解は重要であり、今後、構造解析とin silico解析を組み合わせることにより、複合体構造では相互作用しないとされる領域の重要性など、相互作用の新たな一面が重視されるようになるだろう。それに対し、抗体に代表されるバイオ医薬品開発の高分子創薬は、基本的には面結合の創出、面の創りこみが重視されることに常に留意する必要がある。面と面の相互作用における点結合となるため、低分子創薬のような形状相補性は要請されない。それだけに、構造解析による面結合の理解、その相互作用のダイナミクス(動的構造)をin silicoで解析し、詳述することが本質的に重要である。
前述のように、標的分子の構造的特徴を理解して、低分子・中分子化合物からバイオ医薬品まで広い創薬モダリティから適した分子を創出することが重要である。例えば、2020年はじめから世界的パンデミックを引き起こした新型コロナウイルスSARS-CoV-2に対する治療薬・ワクチンの開発において、ウイルスタンパク質および宿主タンパク質の相互作用の理解が重要であることが改めて示された。これまでに確立されたコロナウイルス治療薬はウイルスを中和する抗体医薬品である。これはウイルス表面のスパイクタンパク質と結合することにより、ヒト受容体ACE2との結合を阻害することでウイルス感染を防ぐ。この際に抗体がいかにスパイクタンパク質を認識するかについて、X線結晶構造解析(第3章-1)とクライオ電子顕微鏡解析(第3章-2)がきわめて短期間に解明され、表面プラズモン共鳴法(第1章-3、 12)やバイオレイヤー干渉法(第1章-14)による分子レベルでの結合解析が進められた。これにより、続く変異株の発生に対しても有効な抗体であるか、また複数の治療抗体を混合する抗体カクテルの設計にも重要な指針を与えた。現在も治療抗体の開発が続いている。
抗体カクテル
複数の特異性の異なる抗体を混ぜ合わせたものを指す。例えば、新型コロナウイルス治療に用いる抗体カクテルでは、それぞれの抗体が異なる箇所(エピトープ)に結合するため、ある変異によりこれを認識する1つ抗体の活性が低下しても、異なるエピトープを認識する他の抗体の活性には影響がない可能性が高い。そのため、抗体カクテルはウイルスの変異に対して耐性をもつことが期待されている。
以上のように、治療抗体の開発にX線結晶構造解析やクライオ電子顕微鏡解析が重要な役割を果たしてきているが、一方で、詳細な相互作用を議論できる高分解能なデータが得られないことも多い。そのような中、最近非常に注目されているAIを基盤とした立体構造予測法AlphaFold2(第2章-1)を用いたドメインのモデルとクライオ電子顕微鏡解析の低分解能構造を組み合わせる研究例も出てきている。さらに、現在進められている低分子・中分子化合物の開発においても、その相互作用解析と構造解析の組み合わせは必須となっている。他方、標的タンパク質の立体構造をベースに相互作用部位に対してin silico創薬を進めることも必須である。ヒット化合物や抗体分子を最適化する際には特に、タンパク質のもつ柔軟な動的構造を加味した分子動力学計算(第2章-4)は重要である。計算資源の問題と折り合いをつけつつ、in silicoスクリーニングと最適化に向けた動的な理解がより効率的に進むことが今後期待される。
相互作用研究の今後
生命現象をつかさどるタンパク質の相互作用解析は、①高次構造情報、②相互作用解析手法、③計算科学の深化と進化、④イメージング技術等の発展による生命科学の新しい展開、といった背景で、最近さらに大きく進展しているといえる。相互作用研究は、基礎科学研究はもとより、創薬研究にも重要であることから、今後、技術的にも、対象疾患を含む研究対象という観点でも、ターゲットバリデーションによる新しい生物学の描写という観点でも、ますます発展するものと思われる。本書は、特に進展著しい方法論を中心に、最先端研究領域を支える技術を、第一線の研究者に執筆いただいている。本書が、生命分子相互作用研究の大きな位置づけを示す羅針盤となることを期待している。
◆文献
1)長門石曉、他:結合熱力学プロファイリングによる創薬。ファルマシア、51:1133-1137、2017
2)「薬系 免疫学 改訂第3版」(植田正、前仲勝実/編)、南江堂、2018
羊土社、2021年12月発行
津本浩平,前仲勝実/編
目次
序【津本浩平,前仲勝実】
概論 生命現象における“相互作用”の考え方【津本浩平,前仲勝実】
第1章 創薬における相互作用解析のスタンダード
Ⅰ 低中分子創薬
1 低分子・中分子創薬における相互作用解析ナビ【前仲勝実】
2 SPRを用いた低分子化合物のスクリーニング【長門石曉,津本浩平】
3 SPRを用いたヒットバリデーション,最適化のためのキャラクタリゼーション【古川 敦,三谷知也】
4 示差走査型蛍光定量法を用いたタンパク質熱安定性解析のスクリーニング【野村尚生】
5 等温滴定型カロリメーター(ITC)を用いた分子間相互作用の熱量評価【長門石曉,津本浩平】
6 マイクロスケール熱泳動法(MST)を用いた分子間相互作用解析【長門石曉,津本浩平】
7 蛍光偏光測定【菊川峰志,尾瀬農之,金城政孝】
8 フラグメント創薬(FBDD)のための溶液NMR実験法【古板恭子,児嶋長次郎】
Ⅱ 抗体創薬
9 抗体創薬における相互作用解析ナビ【津本浩平】
10 シングルセルPCRによるモノクローナル抗体作製法【登内奎介,小野寺大志,高橋宜聖】
11 ファージディスプレイ法を用いた一本鎖抗体の改変【山内聡一郎,小橋川敬博,佐藤卓史,森岡弘志】
12 SPR法を用いた抗体創薬における分子間相互作用解析【黒木喜美子】
13 等温滴定型熱量計(ITC)を用いた相互作用の熱力学的解析【田所高志】
14 BLI(バイオレイヤー干渉法)を用いた抗体エピトープ解析【新山真由美,永田諭志,鎌田春彦】
15 水素-重水素交換質量分析(HDX-MS)実験法による相互作用部位の解析【児玉高志,児嶋長次郎】
16 会合凝集体の検出【木吉真人,柴田寛子,石井明子】
17 SEC-MALSを用いた生体分子の多量体解析【齋尾智英】
1 示差走査型カロリメーター(DSC)を活用した抗体の熱安定性解析【中木戸誠,津本浩平】
19 抗体の立体構造予測と抗原とのドッキング計算【黒田大祐,津本浩平】
第2章 インフォマティクスによる相互作用解析のスタンダード
1 タンパク質アミノ酸配列からの立体構造予測【富井健太郎】
2 タンパク質-タンパク質ドッキング計算による構造予測と相互作用予測【黒田大祐,津本浩平】
3 計算による低分子ドッキング・薬物スクリーニング【福西快文,棚橋 航,真下忠彰,中村寛則】
4 MDシミュレーションによるリガンド結合解析【重田育照】
5 フラグメント分子軌道法に基づく分子間相互作用解析【田中成典】
6 創薬等に役立つインターネット上のデータベース【由良 敬,鈴木博文,栗栖源嗣,川端 猛,木下賢吾,白井 剛,土方敦司,田之倉優】
第3章 ひとつ進んだ相互作用の理解をめざして
1 X線結晶構造解析の流れとポイント・コツ【千田美紀,千田俊哉】
2 クライオ電子顕微鏡で弱い相互作用の複合体構造を解析するための戦略【岩崎憲治,大橋正隆,廣瀬未果,禾 晃和】
3 X線自由電子レーザーを用いたタンパク質の構造解析【島村達郎】
4 生体高分子溶液試料の小角X線散乱解析(BioSAXS)【清水伸隆】
5 高速原子間力顕微鏡によるタンパク質間動的相互作用の一分子計測【内橋貴之】
6 超遠心分析沈降速度法による分子間相互作用解析【丸野孝浩,内山 進】
7 Native-MSによる分子間相互作用解析【西海遥夏,石井健太郎,内山 進】
8 創薬分野におけるAIの活用【長尾知生子,李 秀栄,水口賢司】
索引
からの記事と詳細 ( 生命現象における“相互作用”の考え方:日経バイオテクONLINE - 日経バイオテク )
https://ift.tt/jn8NagE

No comments:
Post a Comment